الكيمياء هي علم مستدام ، يتعامل مع العناصر في الطبيعة بشكل عام ، حيث تتعامل مع الخصائص الكيميائية والفيزيائية لجميع هذه العناصر مع بوصة معينة. لذلك ، تتطلب معرفته قدر الإمكان ، وللمزيد من الصفوف التالية.
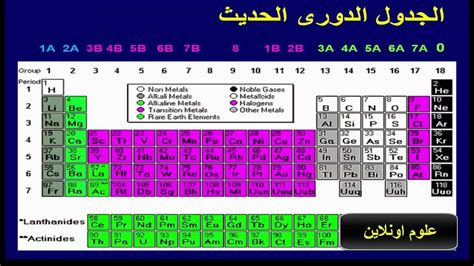
ما هو الجدول الدوري الحديث
هو جدول كيميائي يتضمن 118 عناصرهم من بينهم 92 عناصر فهي موجودة في الطبيعة. الجدول الدوري كما هو الحال في الشكل الحالي ولكنه مرت بالعديد من التطورات أثناء تاريخ الكيمياءومن مراحل تطوير الجدول الدوري:
المرحلة الأولى من الجدول الدوري الحديث
- كانت أول محاولة من قبل العالم الفرنسي أنطوان لافويسيروهذا جلب العناصر التي لا يمكن تصورها إلى مادة أصغر على طاولة مثل أكسيد المغنيسيوم.
- عقبة العالم جون دالتون الذين وضعوا جدولًا زمنيًا تنشأ عليه العناصر اعتمادًا على الكتل الذرية.
- جاء العالم همفري ديفيلإكمال ما فعله أنطوان لافويسير ، حيث شارك كل من الصودا والبوتاسيوم ، وتلقى في نهاية المطاف عناصر الصوديوم والمغنيسيوم ، والتي لاحظت التشابه الكبير بينهما في خصائصها.
- قام أحد العلماء الفرنسيين بإنشاء نظام يساعد على تنظيم العناصر مع الكتلة الذرية ، ولتحديد تقريبًا 60 عناصر رتبهم على جدول زمني اعتمادا على الكتل الذرية.
انظر أيضا: ما هي الكسور في أبسط صورة؟ ما هي أنواع الكسور؟
المرحلة الثانية من الجدول الدوري
- جاء العالم مندلييف ورتب العناصر وفقًا لجدول زمني وفقًا لـ أوزانها الذريةتم قطع البلدان لتخطيط عناصر لم يتم اكتشافها بعد ، كما وضع عناصر مماثلة في خصائصها في مجموعات.
- عالم وليام رامزيالكشف عن عناصر نبيلة تعرف باسم الغازات غير النشطة.
المرحلة الثالثة من الجدول الدوري
- في هذه المرحلة استيقظ ميوزلي تكشف عن تنظيم هذه العناصر على أساس العدد الذري ، وليس على أساس الوزن الذريوفي دراسته للخصائص القائمة على x من بعض العناصر ، حدد مجموعتين lantamids و asinat أدنى الجدول الدورييتم ترتيب عناصر مماثلة في مجموعات أفقية.
- تم تشكيل الجدول الدوري الحديث بواسطة 7 دورات أفقية.
انظر أيضا: تمكنت الجمال من تطوير جدول دوري بأرقام الرباط
أولاً الفئة S
- هناك الحد الأقصى اليسار الجدول الدوري.
- يتكون من مجموعتين مختلفتين.
- تتميز أرقام المجموعة بالحرف A ، وتشمل 1A ، 2A.
ثانيا الفئة P
- تقع هذه الفئة على الحد الأقصى اليمين الجدول الدورييتكون من 6 مجموعات مختلفة.
- تتميز عناصر هذه الفئة أيضًا بالرمز A ، باستثناء عناصر المجموعة الصفر أو الغازات غير النشطة التي تتلقى الرقم (18).
- تبدأ هذه المجموعة من 3Aأو ( 13ينتهي مع مجموعة الصفر.
ثالثاً عناصر الفئة d
- هو الداخل متوسط الدوري ، حيث يتكون من 10 مجموعات الرأس.
- تتميز عناصر هذه الفئة بالحرف B ، باستثناء المجموعة الثامنة ، والتي تتضمن 3 أعمدة رأسية ، ويتم وضع هذه الأعمدة في مجموعة بسبب وجود تشابه كبير بين عناصرها في الخصائص.
- تبدأ هذه المجموعة بالمجموعة 3 ب أو المجموعة 3 ، وينتهي بالمجموعة 2 ب وهو في المجموعة الحديثة من العد 12.
- تُعرف عناصر هذه المجموعة بالعناصر العابرة ، التي تشترك في الفئة S و PCS.
رابعاً عناصر الفئة F
- هذه هي العناصر تحت الطاولة يتميز الرابط بسلسلة اثنين أكتينيديت و lantamids.
تعلم أيضا: الراديو المدرسي في أخلاق جيدة
أهمية الجدول الدوري الحديث
الجدول الدوري الحديث ، الذي يتضمن عناصر في قشرة الأرض ، العدد 118 عناصرمن السهل على الطلاب الحصول على عناصر في مكان واحد من أجل تسهيلها جميعًا ، ومن أهمية الجدول الدوري للكيميائيين وغيرهم المهتمين بدراسة الكيمياء في الاعتراف التالي:
- التفاعلات الكيميائية ونشاط النشاط ، حيث يمكن للعناصر الدخول إلى الجدول الدوري.
- عناصر العنصر في الجدول الدوري التعرف على كل من المجموعة والدورة التي يوجد فيها العنصر.
- الخصائص الكيميائية والفيزيائية للعناصر.
- تعرف على الرقم الذري وعدد الإلكترونات لكل عنصر.
أنواع العناصر الموجودة في الجدول الدوري
يتضمن الجدول الدوري في بعض العناصر التي تحمل صفات ضيقة ، بحيث يتم تصنيفها ضمن فئات العناصر ، بما في ذلك:
- الانتقال الرئيسي: ويشمل الفئة D ، التي تبدأ من الجولة الرابعة في الجدول الدوري.
- الانتقال الداخلي: ويشمل الفئة F ، التي تقع تحت الجدول الدوري ، تتكون من سلسلتين من العناصر.
- النبيل يُعرف أيضًا باسم الغاز غير النشط ، ويتميز بالمستوى الكامل من مستويات طاقة الكهرباء ، لذلك لا يشاركون أو يفقدون أو يكتسبون ذرات ، لذلك لا يدخلون أي تفاعل كيميائي ، وهم داخل الميناء ص.
انظر أيضا: توجد النقاط الموجودة في الجدول أدناه في خط مستقيم من الميل يساوي
خواص عناصر الجدول الدوري الحديث
- معظم مكونات الجدول الدوري في شكل المعادن.
- لتكون معروفة أفقي داخل الجدول الدوري باسم دوراتوالصفوف الرأسية مع مجموعات.
- في مجموعة واحدة في الجدول الدوري ، تشبه الخصائص العناصر ، والعناصر توافق على عدد الإلكترونات في المستوى الأخير من الطاقة.
- بينما على الطاولة الدوري الحديث ينتهي مع أي شخص الغازات غير النشطة.
- يتضمن flzat والاستعارات يتم فصلها عناصر أشباه الموصلات.
تدرج الخواص في الجدول الدوري الحديث
هناك بعض الميزات التي تميز المجموعات التي تمسك بها الرسالة أوهو على النحو التالي:
خاصية الحجم الذرى
- عندما يتم قياس الحجم الذري ومعرفته بمعلومات دائرة نصف قطرها الذرة ، والتي يتم قياسها في وحدة ثنائية الأبعاد.
- في إحدى الدورات ، يتناقص الحجم الذري عن طريق زيادة العدد الذري ، بسبب زيادة قوة الجر الأساسية لإلكترونات الكهرباء الأخيرة.
- وبالتالي فإن الحجم الذري يتناسب مع نسبة الرقم الذري في الدورة.
- في المجموعة العمودية ، يزداد حجم الذرية بزيادة في العدد الذري ، في حين أن الهبوط ، بسبب الزيادة في عدد مستويات الطاقة التي تشغلها الإلكترونات.
- العلاقة مباشرة بين الرقم الذري والحجم الذري في المجموعة.
خاصية السالبية الكهربية
- يعني قدرة الذرة على جذب إلكترونات الترابط الكيميائي تجاهها.
- كل عنصر له قيمة سلبية للكهرباء غير العناصر الأخرى.
- تنقسم العناصر على أساس الإنقاذ الكهربائي إلى: المركبات القطبية ، والمركبات غير القطبية والمركبات الأيونية.
انظر أيضا: ابحث عن الكيمياء في الطب
تدرج الخاصية الفلزية واللافلزية في الجدول الدوري
استمارة الجدول الدوري بواسطة الخاسرو لا معادنو semi -myfysics والغازات غير النشطة.
في الدورة الواحدة
- تبدأ كل دورة بغلي حازم مع الجلسة الأولى.
- عن طريق زيادة العدد الذري في خاصية المعدن (من اليسار إلى اليمين) تنخفض حتى نصل إلى المعدن شبه الموصل.
- ثم يبدأ في الظهور Lvilzatوتزيد الخاصية المعدنية عن طريق زيادة العدد الذري في الدورة ، حتى نصل في النهاية إلى غازات غير نشطة.
في المجموعة الواحدة
- نمو سائل في مجموعة (من أعلى إلى أسفل) ، بسبب زيادة الحجم الذري للعناصر المعدنية ، مما يزيد من سهولة الإلكترونات على مستوى الكهرباء الأخير.
- في مجموعة مناسبة لكل من العدد الذري والممتلكات المعدنية لبزيادة العدد الذري في المجموعة ، تزداد خاصية المعادن للعناصر.






اترك تعليقاً